Tipos de reações química
- Comentários desativados em Tipos de reações química
Primeiramente, o que é uma reação química?
Uma reação química é uma transformação da matéria em que ocorrem mudanças qualitativas na composição química de uma ou mais substâncias reagentes, resultando em um ou mais produtos.
As reações químicas podem ser classificadas segundo diversão critérios. As reações podem ser agrupadas em quatro tipos básicos : Decomposição ou análise; Síntese ou adição; Simples troca ou substituição ou deslocamento; reação de dupla-troca ou dupla substituição.
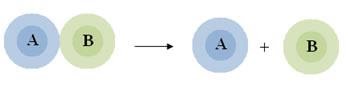
Reação de decomposição ou análise
Ocorre quando uma substância se divide em duas ou mais estruturas mais simples.
Podemos generalizar esse tipo de reação com a seguinte equação:
Exemplo : 2H2O2 -> 2H2O + O2
Reação de síntese ou adição
Ocorre quando duas ou mais substâncias reagem, produzindo uma substância mais complexa.
Exemplo: NH3 + HCl -> NH4Cl
Reação de simples troca ou deslocamento
Ocorre quando uma substância simples reage com uma composta: a substância simples “desloca” ou “troca” parte da molécula composta.
Podemos resumir esse tipo de reação com a seguinte equação:
PARA METAIS: A + BC -> AC + B
PARA AMETAIS: A+ BC-> BA + C
Exemplo: Zn + H2SO4 -> ZnSO4 + H2
Reação de dupla-troca
Ocorre entre duas substâncias compostas, quando ambas permutam seus elementos ou íons.
Observe que o (A) passou a ocupar o “lugar” do (B) e este foi para o “lugar” do (A)
Exemplo: Na2SO4 + BaCl2-> 2NaCl + BaSO4
imagens: https://m.manualdaquimica.com
Types of chemical reactions
First, what is a chemical reaction?
A chemical reaction is a transformation of matter in which qualitative changes occur in the chemical composition of one or more reactive substances, determinants in one or more products.
The reactions can be classified according to criteria. The reactions can be grouped into four basic types: Decomposition or analysis; Synthesis or addition; Simple exchange or replacement or displacement; double-exchange or double-substitution reaction.
Decomposition reaction or analysis
It occurs when a substance divides into two or more simpler structures.
We can generalize this type of reaction with the following equation:
Example: 2H2O2 -> 2H2O + O2
Synthesis or addition reaction
It occurs when two or more substances react, producing a more complex substance.
Example: NH3 + HCl -> NH4Cl
Simple exchange reaction or displacement
It occurs when a simple substance reacts with a compound: a simple substance “displaces” or “exchanges” part of the compound molecule.
We can summarize this type of reaction with the following equation:
FOR METALS: A + BC -> AC + B
FOR AMETALS: A + BC-> BA + C
Example: Zn + H2SO4 -> ZnSO4 + H2
Double-exchange reaction
It occurs between two compound substances, when both exchange their elements or ions.
Note that (A) has taken the place of (B) and this has gone to the “place” of (A)
Example: Na2SO4 + BaCl2-> 2NaCl + BaSO4
images:https://m.manualdaquimica.com
Made by: Matheus Estevão, Pedro Julio, Pedro Miguel, João Baggio, João Guasque, Henrique Ozorio e Henrique Yasuda.