Os átomos raramente agirem sozinhos. Muitos para ficarem estáveis ( 8 elétrons na última camada) se juntam a outros por meio das ligações químicas. São 3 tipos: covalente, iônica e metálica.
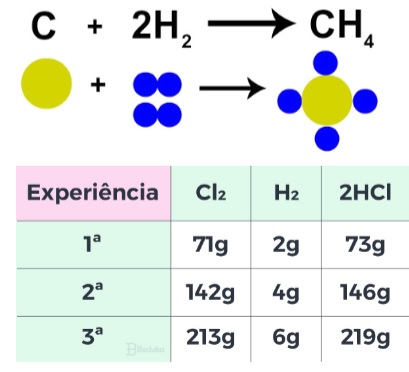
A ligação covalente é um dos tipos de ligação química que ocorre com o compartilhamento de pares de elétrons entre átomos de hidrogênio, ametais e semimetais que compartilham entre si pares de elétrons.
As ligações metálicas ocorrem entre metais os quais têm tendência a perder elétrons. Determinadas as condições normais de temperatura e pressão, estas mesmas ligações favorecem que as substâncias adquirem um elevado ponto de fusão e vaporização.
As ligações iônicas se formam pela atração de íons de cargas opostas, quando dois elementos (um metal e outro ametal ou hidrogênio) se encontram, ocorre um compartilhamento de elétrons. Por exemplo: o cloro e sódio, o que acontece é que quando eles se encontram, os sete elétrons do cloro “retiram” o último elétron do sódio, surgem então dois íons o cloro(Cl-) e o sódio(Na+). Ou seja, ocorre uma adição ou perda dos elétrons
Com isso podemos concluir que os pequenos elementos que nos completam são muito mais complexos do que nós imaginamos.
Chemical Bonds
Atoms rarely act alone. Too many to be stable (8 electrons in the last layer) join each other through chemical bonds. There are 3 types: covalent, ionic, and metallic.
Covalent bonding is one of the types of chemical bonding that occurs with sharing of pairs of electrons between hydrogen atoms, non-metals, and semimetals that share pairs of electrons.
Metallic bonds occur between metals which tend to lose electrons. Given the normal conditions of temperature and pressure, the same bonds favor the substances acquiring a high melting and vaporization point.
Ionic bonds are formed by the attraction of oppositely charged ions, when two elements (one metal and the other non-metal or hydrogen) meet, an electron sharing occurs. For example: chlorine and sodium, what happens is that when they meet, the seven electrons of chlorine “take out” the last electron of sodium, then two ions appear, chlorine (Cl-) and sodium (Na+). That is, there is an addition or loss of electrons
With this, we can conclude that the small elements that complete us are much more complex than we imagine.
Autoras: Maria Beatriz, Maria Clara, Milena, Mariana e Isabela.
fonte de imagem:https://lh6.googleusercontent.com/1ehsjugIuNSsOOJ8M-nSuRvGGkKemCsSB1v0Fa-nb2Xs0rOqz-uSd3dNzA_6xxxP0WDeYDHtqwfkYeN4hz6XMzKhcM72FJTi6RnRBDpYGQEDD9VFiXE142VGgN0poqptiN3xR7Si